Děkujeme Chovatelskému družstvu Impuls za zapůjčení tohoto článku, zvláště pak autorce MVDr. Lence Povolné za velmi pěkné zpracování. Obdobné články naleznete v Chovatelských impulsech na webových stránkách družstva.
Zabřezávání krav a jalovic patří k velmi často diskutovaným tématům. Nezřídka se chovatelé při problémech se zabřezáváním obrací na dodavatele inseminačních dávek. Každá inseminační stanice býků by měla garantovat kvalitu inseminačních dávek při expedici. Žádná inseminační stanice ovšem nemůže garantovat, jak je s inseminačními dávkami zacházeno, než se dostanou kam mají.
Nedávno jsem narazila na zajímavé články týkající se manipulace s inseminačními dávkami a vlivu špatného zacházení na jejich kvalitu. Nesprávné zacházení a přerušení chladícího řetězce má za následek nevratné poškození spermií a snížení fertility inseminační dávky. Teplotní poškození spermií je trvalé a není ho možné napravit znovu ponořením do kapalného dusíku.
Jak tomuto poškození předejít a proč k němu dochází?
Co se děje při výrobě inseminačních dávek (ID)
Cílem úspěšné výroby inseminačních dávek je nahradit tekutinu uvnitř buněk (spermií) látkami, které mají buňky a jejich membrány ochránit před působením nízkých teplot. Tyto látky se nazývají kryoprotektiva a jsou součástí průmyslově vyráběných ředidel spermatu. Další fází, jak ochránit fertilitu spermií, je vlastní průběh a rychlost mrazení, které dosáhneme pomocí nastavení křivky mrazení inseminačních dávek ve speciálním mrazícím boxu. Tím minimalizujeme vznik krystalů uvnitř buněk, navíc při pomalém mrazení s přítomností kryoprotektiv se tvoří pouze mikroskopické krystaly, které nepoškozují buněčné membrány. Inseminační dávky trvale uložené v kapalném dusíku, tzn. při teplotě -196 °C, mají životnost 1000 let. Při takto nízké teplotě totiž dochází k úplnému zastavení metabolismu buněk a buňky prakticky nestárnou.
Na konci výrobního procesu tedy máme inseminační dávky, jejichž kvalita je ještě ověřena rozmrazením 2 ID z každého skoku býka. Při minimálním počtu 30 % aktivních spermií se v jedné inseminační dávce nachází kolem 10 miliónů spermií s progresivním pohybem.
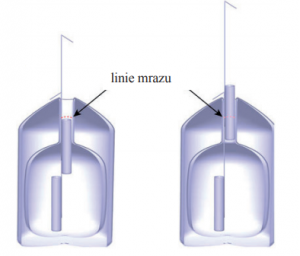
Teplota v hrdle kontejneru
Většina z Vás se již s kontejnerem (Dewarovou nádobou) na uskladnění inseminačních dávek setkala. Pro názornost, jak takový kontejner vypadá na řezu i s uložením kanystrů, uvádím Obr. 1. Dewarova nádoba je v podstatě dvoustěnná nádoba. Z jejího mezistění je vyčerpán vzduch a vzniklé vakuum spolu s izolací na bázi minerální vaty tvoří izolační vrstvu. V horní polovině hrdla každého kontejneru je oblast s příliš vysokou teplotou, kterou by dávky měli překročit pouze těsně před vlastním rozmrazením v průběhu inseminace, nebo při přesunu mezi kontejnery. Hranici, nad kterou by dávky neměli být z kontejneru vytaženy při běžné manipulaci, označujeme jako tzv. “linii mrazu” viz Obr. 2. Teplota v této oblasti se pohybuje kolem -100 až -130 °C, viz. Obr. 3.
Obr. č. 1
Obr. č. 2
Obr. č. 3
Poškození dávek při manipulaci
- Pokud dochází k manipulaci se spermatem, dávky by měli opustit prostředí kapalného dusíku jen na velmi krátkou dobu. Tato doba by neměla překročit 5 až 10 sekund v závislosti na okolní teplotě. Zachycení kanystru pomocí peanu v hrdle kontejneru na několik minut je nepřípustné. (viz. foto 1)
- K manipulaci s inseminačními dávkami by vždy měla být použita pinzeta. Nikdy se nedotýkejte ID prsty. (viz. foto 2 a foto 3)
Foto č. 1-3
- Důležité je mít přehled, kde se v kontejneru nachází jednotliví býci. Při hledání nemusíte vytáhnout všechny kanystry, abyste našli toho správného býka, ale jdete na jisto. Ideální je mít u kontejneru “mapu”, kde jsou uvedeny informace o uložení jednotlivých býků v kanystrech vč. barvy pejet (viz. foto 4)
Foto č. 4
- Vždy je nutné v kontejneru udržovat dostatečnou hladinu dusíku. Dolévání dusíku by mělo být pravidelné s týdenním intervalem u malých kontejnerů (do 3 litrů) a s 2-3 týdenním intervalem u kontejnerů s velkým objemem (20 litrů). Je nutné počítat s vyšším odparem při časté manipulaci s ID, dále pokud je kontejner transportován např. v autě inseminačního technika, a samozřejmě v letních měsících. Při snížení hladiny kapalného dusíku cca na polovinu celkového objemu kontejneru již dochází ke zvýšení odparu ve srovnání s plným kontejnerem. Jinak řečeno, čím méně je kapalného dusíku v kontejneru, tím rychleji ubývá.
Proč dochází k poškození ID
Inseminační dávky jsou vzhledem k nepříznivému poměru “velký povrch x malý objem” náchylné ke zvýšení teploty. Pokud opustí prostředí kapalného dusíku, poměrně rychle se teplota uvnitř pejety dostane nad kritických -130 °C. Při opakovaném vystavení ID teplotě vyšší než -130 °C a následném ponoření zpět do kapalného dusíku dochází k reorganizaci a transformaci krystalů uvnitř buněk. Malé krystaly se slučují do velkých a dochází k poškození nejen buněčných membrán (akrozom), ale i buněčných organel (mitochondrie, chromozomy) tzv. rekrystalizací. Tím dochází ke ztrátě schopnosti oplození. Velikost poškození spermií tedy závisí na tom, jak vysoko se teplota dostane nad -130 °C a jak dlouho na spermie tato teplota působí.
Snížení kvality ID v průběhu inseminace
Ke snížení kvality ID nedochází jen při nesprávné manipulaci a transportu, ale může k ní dojít i v průběhu vlastní inseminace.
Rozmrazení ID má svá pravidla, která minimalizují teplotní šoky spermií. Především je nutné dodržet teplotu vodní lázně a čas při rozmrazení ID mezi 35 °C (40 vteřin) a 37 °C (30 vteřin). Teplotu je vždy nutné ověřit pomocí teploměru nebo speciální destičky dodávané výrobcem rozmrazovacích zařízení. (viz. foto 5)
Foto č. 5
Důležité je důkladné osušení povrchu pejety. I nepatrné množství vody vede k porušení osmotické rovnováhy a k poškození povrchové membrány hlavičky spermie.
Z praktického hlediska je vhodné po rozmrazení setřepat vzduchovou bublinku uvnitř pejety směrem k zatavenému konci. Nemusíte mít strach, protřepáním se spermie nijak nepoškodí a díky této manipulaci neztratíte 1-5 % objemu ID. (viz. foto č. 6)
Foto č. 6
Neméně důležitý je i úhel zastřižení pejety. Použitím speciálních zastřihovacích nožů (viz. foto č. 7) zastřihnete konec kolmo, nikoli šikmo, jako se to stává při použití běžných nůžek. Kolmé zastřižení způsobí při zasunutí pejety do inseminační zbraně a nasunutím krycí pipety, že krycí pipeta a pejeta jsou v těsném kontaktu a celý objem ID je deponován do pohlavních orgánů. V případě šikmého zastřižení vzniklá netěsnost způsobí, že část objemu ID zůstane uvnitř krycí pipety.
Foto č. 7
V chladnějších měsících a zejména v zimním období je nutné předehřát inseminační zbraň třením, nebo používat zahřívací toulec. Teplota inseminační zbraně by neměla klesnout pod 37 °C na více než 1 minutu. Doba mezi rozmrazením ID a inseminací by neměla překročit 5 minut. Proto je nutné rozmrazit pouze tolik dávek, které jsem schopen použít během 5 minut.
Vědecké důkazy o poškození dávek při manipulaci
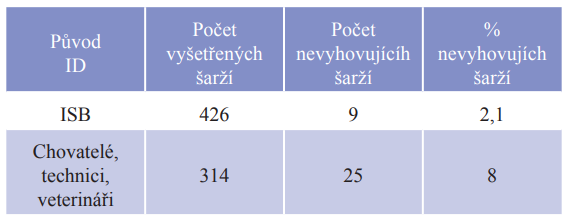
Doktor Stroud ve své práci uvádí signifikantní vliv původu jednotlivých šarží, které vyšetřoval. Cílem jeho práce bylo zhodnocení kvality inseminačních dávek před jejich použitím u plemenic připravených k embryotransferu. Všechny dávky pocházely od býků masných plemen. Inseminační dávky kontroloval jeden člověk, aby bylo sníženo riziko rozdílného subjektivního hodnocení, vyšetření probíhala v průběhu roku. V závěrečném hodnocení byly dávky rozděleny na dvě skupiny. První skupina zahrnovala dávky, které byly na místo použití dovezeny přímo z inseminačních stanic. Původ dávek ve druhé skupině byl z farmových kontejnerů a kontejnerů inseminačních techniků a veterinářů. Výsledky shrnuje tabulka č. 1.
Tabulka č. 1 Počet poškozených dávek při manipulaci
Z celkového počtu 426 šarží původem z inseminačních stanic bylo za nevhodné k použití označeno pouze 9 šarží (2,1 %). U šarží původem z farmových kontejnerů a ostatních zdrojů bylo jako nevyhovující označeno 25 šarží z 314, což představuje 8 % nevyhovujících šarží.
Lieberman a kol. se pokusili kvantifikovat poškození spermií pomocí změn motility, přežitelnosti a poškození akrozomu v inseminačních dávkách při několikanásobném vytažení ID ze standardní 3 litrové Dewarovy nádoby (YDS-3, Chart). Běžné ID umístěné v kanystru bez gobletu byly na dobu 1 minuty vytaženy z kontejneru a vystaveny okolní teplotě 23 °C (+/-0,2 °C). Překvapující bylo, že při 20 násobné expozici ID okolní teplotě došlo ke snížení procenta živých i motilních spermiií, ale pokles přežitelnosti a motility nebyl statisticky významný. Zatímco poškození akrosomu spermií se významně zvyšovalo s počtem expozic, (pozn. autora – akrozom je povrchová struktura na hlavičce spermie, obsahující hydrolytické enzymy a povrchové antigeny nezbytné pro akrosomální reakci a následný proces penetrace spermie do vajíčka = vlastní oplození). Výsledky shrnuje Graf č. 1.
Graf č. 1
Druhý pokus ve stejné studii se zaměřil přímo na integritu akrozomu a inseminační dávky byly vystaveny okolní teplotě na 0,5 až 4 minuty při celkovém počtu 0-40 expozic. Výsledky jsou patrné z Grafu č. 2. Čím delší expozici a čím vyššímu počtu expozic byly dávky vystaveny, tím méně obsahovali spermií s nepoškozeným akrozomem.
Graf č. 2
Na závěr ještě jeden poznatek – pokud máte v kanystru 100 ID, než zpracujete poslední dávku, kanystr vytáhnete nad linii mrazu 100x.
MVDr. Lenka Povolná, Chovatelské družstvo Impuls, družstvo
Literatura:
Lieberman, D. a kol., Maintaining semen quality by improving cold chain equipment used in cattle artificial insemination. Scientific Reports, June, 2016
Stroud, B., Consequences of mishandling frozen semen and embryos, Applied Reproductive Strategies in Beef Cattle, December, 2012












 www.agropress.cz
www.agropress.cz


